Généralités sur les médicaments
Médicaments pédiatriques, médicaments génériques, Dénomination Commune Internationale, Autorisation de Mise sur le Marché… Voici quelques définitions et généralités pour vous y retrouver.
Qu’est-ce qu’un médicament ?
Un médicament est une substance ou un mélange de substances destiné à soigner, à guérir ou à prévenir des maladies, ou encore à diminuer ou à éviter certains symptômes.
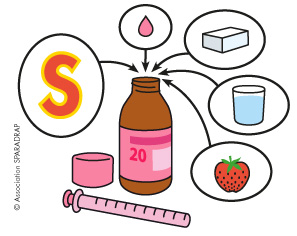 Plusieurs éléments composent un médicament :
Plusieurs éléments composent un médicament :
- un principe actif : la substance destinée à agir contre la maladie ou le symptôme (il peut y avoir plusieurs principes actifs dans un même médicament) ;
- des excipients : des substances qui donnent au médicament une forme, un goût, une stabilité (liant, diluant, conservateur), et qui influencent la manière dont il va être diffusé dans le corps. Par exemple, un sirop contient en plus du principe actif, de l’eau, du sucre, un colorant et un arôme.
Le dosage
C'est la quantité de principe actif contenue dans le médicament.
Le dosage est indiqué sur la boîte à côté du nom (en milligrammes, en pourcentage…). Un même médicament peut exister dans des dosages différents pour s’adapter à l’âge et au poids ou à la pathologie de la personne à traiter. Par exemple, le Doliprane® existe en sachets de 150mg (pour des enfants de 8 à 30 Kg), ou de 300 mg (pour des enfants de 16 à 48 kg).
La forme pharmaceutique (ou forme galénique)
Il s'agit des différentes formes sous lesquelles le médicament peut se présenter : sirop, comprimé, pommade, cachet effervescent, gélule, solution injectable, suspension buvable, granules, poudre, spray, suppositoire…
Le nom des médicaments
Chaque médicament possède plusieurs noms :
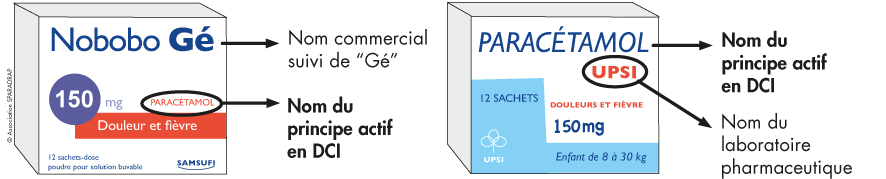
- le nom commercial qui figure en gros sur la boîte. Il est choisi par le laboratoire pharmaceutique qui fabrique le médicament ;
- la dénomination commune internationale (DCI) qui est le nom du principe actif contenu dans le médicament. Ce nom, défini par l'Organisation mondiale de la santé, est conçu pour être utilisable dans un grand nombre de langues et pour limiter le risque d’erreurs. Il est noté sur la boîte, en petit sous le nom commercial.

Par exemples :
- l’Advil® et l’Antarène® sont deux noms commerciaux de médicaments qui contiennent le même principe actif : l’ibuprofène (DCI) ;
- le Doliprane® et l’Efferalgan® sont deux noms commerciaux de médicaments qui contiennent le même principe actif : le paracétamol (DCI).
A noter : depuis le 1er janvier 2015, sauf pour quelques exceptions, les médecins doivent prescrire les médicaments en dénomination commune internationale (DCI), c'est à dire en utilisant le nom du principe actif, son dosage et sa forme.
> Pour en savoir plus, voir l'article de Que Choisir
L’autorisation de mise sur le marché
En France, tous les médicaments sont soumis à une autorisation de mise sur le marché (AMM), après la réalisation d’études cliniques chez des personnes malades. Cette autorisation est donnée par une Agence du médicament (européenne ou française), qui détermine si le rapport bénéfice/risque est favorable, c’est-à-dire si l’efficacité de traitement du médicament est suffisante par rapport aux risques qu’il peut entraîner (effets indésirables).
Les médicaments réservés à l’enfant reçoivent une AMM spécifique pour une utilisation en pédiatrie, après la réalisation d’études cliniques chez l’enfant.
Les médicaments pédiatriques
Il existe des présentations de médicaments conçues spécialement pour les enfants, selon leur âge. Les enfants ne sont pas des adultes en miniature. Parce qu’ils sont plus jeunes et en plein développement, leur organisme ne réagit pas de la même manière aux médicaments que celui des adultes.
Certains médicaments utilisés pour soigner les enfants n’existent pas sous forme adaptée aux enfants. Cela concerne principalement le traitement des maladies chroniques.
> Pour en savoir plus, voir aussi la page : Médicaments et maladies chroniques
Les médicaments génériques
Un médicament générique est une copie d’un médicament original (appelé aussi «spécialité de référence » ou « médicament princeps »). Cette copie doit avoir la même composition en principe(s) actif(s), la même présentation (comprimé, pommade…). En revanche, les excipients peuvent être différents, à condition que le médicament se comporte de la même manière que le médicament original dans l’organisme.
Reconnaître un médicament générique
Le nom d’un médicament générique peut être indiqué de deux façons :
- soit la DCI du principe actif suivi du nom du laboratoire pharmaceutique qui le vend, (par exemples « Ibuprofène ARROW » ou « Ibuprofène BIOGARAN ») ;
- soit le nom commercial donné par le laboratoire suivi de la mention « Gé » (par exemple « ANTARENE Gé » ).
Comme tous les médicaments, les génériques sont soumis à une autorisation de mise sur le marché (AMM).
Générique ou pas générique ?
Parce qu’ils sont généralement moins chers que le médicament original, leur utilisation est encouragée par l’Assurance Maladie pour diminuer les dépenses publiques de santé. Votre pharmacien a l’obligation de vous proposer le médicament générique correspondant à la prescription du médecin. Vous pouvez néanmoins demander à votre pharmacien de vous donner le médicament original. Il sera alors moins remboursé par l’Assurance Maladie ou vous ne bénéficierez pas du tiers payant.
Dans certaines situations particulières (traitement de l'épilepsie, de l'hypothyroïdie, traitement immunosuppresseurs en cas de greffe…), il est important de toujours donner exactement le même médicament : même marque, même dosage. Le médecin précise alors sur l’ordonnance que le médicament est « non substituable » et dans ce cas, votre pharmacien ne vous proposera pas autre chose.
Dans tous les cas, votre médecin et votre pharmacien peuvent vous conseiller sur l’utilisation d’un médicament générique plutôt qu’un médicament original.
> En savoir plus sur les médicaments génériques
La pharmacovigilance
La pharmacovigilance est la surveillance des médicaments tout au long de leur "vie". Cela consiste à recueillir toutes les informations utiles, notamment sur les effets indésirables potentiellement liés à leur utilisation dans le cadre de leur autorisation de mise sur le marché, mais aussi d'autres utilisations : surdosages, erreurs...
Tous les médicaments réservés à l'Homme sont concernés. Certains médicaments peuvent faire l’objet d’une surveillance spécifique lorsqu’ils contiennent une nouvelle substance active ou quand les autorités souhaitent disposer de données complémentaires sur leur utilisation à long terme.
Cela permet de repérer les risques et réviser le cadre dans lequel les médicaments sont utilisés : modifier si besoin leur notice, leur dosage... et jusqu'à retirer leur autorisation de mise sur le marché si nécessaire.
Qui participe à la surveillance des médicaments ?
En France, c'est l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) qui centralise et pilote la surveillance. Elle participe également au système de surveillance à l'échelle européenne.
Les entreprises du médicament doivent mettre en place en interne un service de pharmacovigilance pour étudier et rapporter à l'ANSM tout risque lié à l'utilisation des médicaments qu'elles commercialisent.
Les professionnels de santé qui prescrivent des médicaments, les administrent et assurent le suivi médical des patients, ont un rôle essentiel pour repérer et déclarer sans délai tout effet indésirable aux centres régionaux de pharmacovigilance.
Les patients et associations de patients peuvent déclarer directement un effet indésirable lié à un médicament, sans passer par un professionnel de santé, via le portail mis en place par le Ministère de la santé.
> Voir le portail pour déclarer un effet indésirable
> En savoir plus sur la pharmacovigilance
Se procurer des médicaments
Les médicaments ne peuvent être vendus que par des pharmaciens ou des préparateurs en pharmacie supervisés par un pharmacien. Les pharmaciens travaillent dans les pharmacies de ville (officines) ou à l’hôpital.
Dans votre pharmacie de ville
 Vous pouvez y trouver tous les médicaments autorisés à la vente en dehors de l'hôpital, avec ou sans ordonnance.
Vous pouvez y trouver tous les médicaments autorisés à la vente en dehors de l'hôpital, avec ou sans ordonnance.
Votre pharmacien doit vous procurer des médicaments sous une forme prête à l'emploi adaptée à votre enfant. Si le médicament n'existe pas sous une forme pédiatrique, le pharmacien réalise ou commande une préparation. Il vous précise aussi les modalités d'administration des médicaments qu'il vous vend.
De nombreux produits en vente libre (sans ordonnance), même ceux dits « naturels », ne sont pas inoffensifs.
Il faut être vigilant concernant leur utilisation, surtout chez les enfants, car ils peuvent aussi avoir des effets indésirables. Par exemple, certaines huiles essentielles peuvent provoquer des irritations en cas de contact ou des intoxications si elles sont avalées. Votre pharmacien est là pour vous conseiller sur le choix d'un produit et son mode d'utilisation.
A noter :
- des laboratoires pharmaceutiques connus commercialisent certains produits sous des formes et dans des emballages qui ressemblent très fortement à des médicaments et peuvent prêter à confusion.
> Pour en savoir plus, voir l'article de Que Choisir
- depuis le 15 janvier 2020, certains médicaments anti-douleur et anti-pyrétiques (paracétamol, ibuprofène...) en vente sans ordonnance sont désormais disponibles uniquement sur demande aux pharmaciens.
> Pour en savoir plus, voir le point d'information de l'Agence Nationale de Sécurité des Médicaments et des produits de santé (ANSM)
Sur Internet
 Seuls les médicaments délivrés sans ordonnance peuvent être vendus sur Internet, et uniquement par des pharmacies ayant reçu l’agrément d’une Agence régionale de santé (ARS).
Seuls les médicaments délivrés sans ordonnance peuvent être vendus sur Internet, et uniquement par des pharmacies ayant reçu l’agrément d’une Agence régionale de santé (ARS).
Attention :
certains sites non agréés vendent des produits non autorisés ou qui peuvent être de mauvaise qualité. Pour savoir si le site que vous consultez est celui d’une pharmacie agréée, vérifiez la présence du logo ci-contre. Il doit faire un lien vers le site de l’ordre des pharmaciens qui liste toutes les pharmacies autorisées à vendre des médicaments sur Internet.
> Consulter le site de l’ordre des pharmaciens pour connaître la liste des pharmacies agréées
A l’hôpital
Les établissements de santé ont souvent une pharmacie interne qui permet de délivrer ou de préparer les médicaments pour les personnes hospitalisées.
Pour certaines maladies rares ou chroniques, les médicaments nécessaires ne sont pas disponibles dans les pharmacies de quartier. Dans ce cas, les pharmaciens des hôpitaux sont autorisés à les délivrer aux familles, même si l’enfant n’est pas hospitalisé. Cela s'appelle une rétrocession.
Prix de vente et coût des médicaments
Lorsqu’un médicament est remboursé, même partiellement, par l’Assurance Maladie, toutes les pharmacies le vendent au même prix.
Lorsqu’un médicament n’est pas remboursé par l’Assurance Maladie, chaque pharmacien décide librement de son prix de vente. Il peut donc y avoir des différences de prix plus ou moins importantes d’une pharmacie à l’autre.
Selon les cas, voici ce que vous allez payer :
- le médicament est partiellement remboursé et vous disposez d’une complémentaire santé :
si votre mutuelle ne prend pas en charge la totalité du coût non remboursé par l'Assurance maladie, vous payez la différence. Dans le cas contraire, vous ne payez rien ;
- le médicament est partiellement remboursé et vous n’avez pas de mutuelle :
vous devez payer au pharmacien la part qui n’est pas remboursée par l’Assurance maladie ;
- le médicament n’est pas remboursé : vous devez payer la totalité du prix du médicament au pharmacien, sauf accord particulier de votre mutuelle. Si le médecin prescrit un médicament non remboursé, il doit vous en informer au moment de rédiger son ordonnance ;
- votre enfant souffre d'une affection longue durée (ALD) : les soins et les médicaments liés à la maladie sont pris en charge en grande partie par l’Assurance Maladie.
> En savoir plus sur les ALD
> En savoir plus sur le prix et le remboursement des médicaments
Comprendre l'ordonnance et la notice
Posologie, dosage, contre-indications, effets indésirables… Pour bien utiliser un médicament, il est nécessaire de comprendre de nombreuses informations. Elles sont indiquées sur l’ordonnance du médecin, sur la boîte ou la notice du médicament et parfois écrites à la main par le pharmacien sur la boîte pour vous aider. Voici quelques éléments à retenir.
L’ordonnance du médecin
 Elle doit en principe préciser :
Elle doit en principe préciser :
- le nom, le poids et la date de naissance de votre enfant – c’est obligatoire, car la dose de médicament à donner est fonction de l’âge et du poids ;
- le nom du médicament. Normalement, le médecin doit noter la DCI (Dénomination Commune Internationale) du principe actif (la molécule active pour lutter contre la maladie), mais malheureusement, c’est encore souvent le nom commercial qui est utilisé ;
> Pour en savoir plus, voir l'article de Que Choisir - sa forme : sirop, comprimés…
- son dosage : en milligrammes, en pourcentage...
> Pour en savoir plus, voir le chapitre « Qu’est-ce qu’un médicament »
Le médecin indique aussi la posologie, c'est-à-dire comment donner le médicament à votre enfant :
- le nombre de prises dans la journée (3 fois par jour ; matin, midi et soir…) ;
- la quantité par prise (1 cuillerée, 1 comprimé, dose/kg…) ;
- la durée du traitement (pendant 5 jours…) ;
- la façon de prendre le médicament (à jeun, pendant ou hors des repas…).
N'hésitez pas à relire l'ordonnance avant de partir de chez le médecin : il importe que vous puissiez relire et comprendre sans difficultés tous ces éléments.
Dans certains cas particuliers, il est possible que votre médecin fasse une prescription différente des mentions présentes sur la notice d’utilisation. Il vous explique alors pourquoi. En cas de doute, n’hésitez pas à le contacter pour vérifier.
Le rôle du pharmacien
 Le pharmacien vous rappelle comment donner le médicament à votre enfant (à quels moments, en quelle quantité et de quelle manière), ainsi que sur le meilleur moment pour prendre le médicament selon les contraintes familiales. Il doit s'assurer que la prescription et la posologie sont adaptées à votre enfant. En cas de doute, il appelle votre médecin.
Le pharmacien vous rappelle comment donner le médicament à votre enfant (à quels moments, en quelle quantité et de quelle manière), ainsi que sur le meilleur moment pour prendre le médicament selon les contraintes familiales. Il doit s'assurer que la prescription et la posologie sont adaptées à votre enfant. En cas de doute, il appelle votre médecin.
Vous pouvez lui demander conseil si vous pensez que votre enfant peut avoir des difficultés à prendre son médicament sous la forme prescrite (difficulté à avaler un comprimé, sirop au goût particulier…).
Quand le pharmacien vous donne un médicament générique à la place du médicament original, il écrit sur la boîte le nom noté sur l’ordonnance pour que vous puissiez faire le lien et reconnaître de quel médicament il s’agit.
Il peut aussi vous aider à déterminer si votre enfant subit un effet indésirable ou une interaction en se basant sur les symptômes.
Les mentions sur la boîte du médicament
Vous y trouvez des informations utiles, surtout s’il s’agit d’un médicament acheté sans ordonnance :
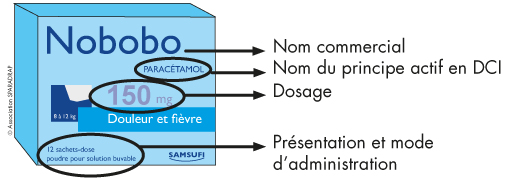
- le nom commercial du médicament, suivi de la DCI de son principe actif ;
- le dosage du principe actif (en mg, en pourcentage…) ;
- la forme et le mode d’administration (ex : solution buvable, comprimé sécable…) ;
- éventuellement des précisions sur la façon dont le principe actif est libéré dans le corps, par exemple :
- LP = Libération prolongée, c’est-à-dire que le médicament est actif longtemps qu'une forme standard,
- LM = libération modifiée (ou différée), si le principe actif est libéré à un moment ou un lieu différent par rapport à une forme conventionnelle, par exemple dans l’intestin au lieu de l’estomac.
Le nom du médicament et son dosage doivent également être notés en braille sur la boîte du médicament.
Attention :
sans ordonnance ou informations ajoutées sur la boîte par le pharmacien, il sera nécessaire de se reporter à la notice d’utilisation pour savoir exactement comment donner le médicament à votre enfant. Il est donc important de la conserver pour pouvoir la consulter si besoin :
- soit dans la boîte avec le médicament ;
- soit pour des raisons pratiques, dans une boîte dédiée qui rassemble toutes les notices.
> La notice d'utilisation de chaque médicament est également consultable sur Internet
La notice d’utilisation du médicament
Avec ou sans ordonnance, il est toujours utile de lire la notice. Cela peut sembler fastidieux mais elle est aujourd’hui plus simple à consulter et il est vraiment conseillé de le faire car elle apporte beaucoup d'informations importantes sur le bon usage du médicament. Une notice de médicament comporte les 6 rubriques suivantes :
1- Qu’est-ce que ce médicament ?
Cette rubrique donne la Dénomination Commune Internationale (DCI), c'est à dire le nom du principe actif, et précise les indications du médicament : pour quel(s) traitement(s) il est recommandé et à qui il est destiné (enfants de plus de 2 ans, de 15 ans, adultes…).
2- Quelles sont les informations à connaître avant de le prendre ?
Cette rubrique est importante car elle explique :
- dans quels cas il ne faut jamais prendre le médicament (allergies, problèmes de santé, prise d'autres médicaments…) ;
- les situations où il faut demander l’avis de son médecin ;
- les associations à éviter avec d’autres médicaments, certains aliments ou boissons ;
- les précautions à prendre dans certaines situations.
3- Comment prendre ce médicament ?
Cette rubrique précise :
- la posologie : la quantité de médicament à prendre selon l’âge et le poids de votre enfant et à quelle fréquence ;
- le mode et la voie d’administration : de quelle manière prendre le médicament (avaler avec un verre d’eau, faire fondre sous la langue…) ;
- le mode d’emploi et de reconstitution : si le médicament n’est pas prêt à l’emploi ou s’il nécessite une manipulation particulière (ajout d’eau, mélange à faire…) ;
- la durée du traitement et ce qu’il faut faire si on a pris trop de médicament ou si on a oublié de le prendre.
4- Quels sont les effets indésirables éventuels ?
La notice liste tous les effets qui sont connus, en précisant s’ils sont plutôt fréquents, rares, exceptionnels… La consulter peut être utile pour savoir à quoi s'attendre et reconnaître des effets indésirables s'ils surviennent. Cette liste est souvent longue et peut vous inquiéter, voire vous inciter à ne pas poursuivre le traitement. Néanmoins, votre médecin a prescrit le médicament à votre enfant car il pense que les bénéfices attendus sont plus importants que les désagréments causés par de potentiels effets indésirables.
Si vous constatez un effet indésirable, informez-en immédiatement votre médecin. Depuis 2013, vous pouvez aussi signaler vous-même directement tout effet indésirable à l’Agence nationale de sécurité du médicament et des produits de santé (ANSM). N’hésitez pas : en effet, si les signalements sont nombreux pour un médicament, cela peut permettre de modifier son Autorisation de mise sur le marché (AMM), voire la remettre en cause et être utile à tous.
> Lien vers le portail de signalement des effets indésirables
5- Comment conserver ce médicament ?
Il est utile de consulter cette rubrique, car certains médicaments se conservent au réfrigérateur, ou à l'abri de la lumière par exemple.
Cela permet également de connaître la durée de conservation d’un médicament une fois son emballage ouvert. Par exemple, lorsqu’ils sont entamés, le contenu des flacons de sirop, des collyres ou des tubes de pommade se conserve moins longtemps que la date de péremption indiquée sur la boîte.
6 – Informations supplémentaires
Cette rubrique liste tous les « ingrédients » du médicament :
- la DCI du principe actif et son dosage ;
- les excipients (tous les autres composants qui donnent au médicament sa forme, sa couleur, son goût, la manière dont il va être absorbé par le corps…).
Elle donne aussi le nom du laboratoire pharmaceutique qui commercialise le médicament ainsi que l’usine qui le fabrique et sa localisation.
Donner ou non un médicament ?
Votre enfant est fiévreux, il se plaint, il s’est cogné, il a mal à la gorge… Dans quelles situations lui donner un médicament ou pas ? La réponse est variable selon la situation, l’âge de votre enfant, l’expérience que vous avez déjà...
 En automédication
En automédication
Dans des situations banales ou fréquentes, vous pouvez être amené à donner un médicament à votre enfant sans consulter un médecin. Vous disposez le plus souvent du nécessaire dans la pharmacie familiale (antiseptique, médicament anti-douleur…), mais il n’est pas toujours utile d’y recourir.
Les bobos du quotidien
Pour « soigner » ou calmer les bobos du quotidien (bosses, égratignures, petites plaies, piqûres d’insectes, brûlures légères…), il existe des gestes simples très utiles :
- rassurer votre enfant (câlin, bisou magique…) ;
- l’installer confortablement ;
- le distraire ;
- quand c’est nécessaire, désinfecter avec un produit qui ne pique pas, appliquer un pansement ;
- selon la situation, appliquer du chaud ou du froid, en faisant attention :
=> à envelopper toute poche congelée dans un linge avant son utilisation,
=> à vérifier la température (souvent sous-estimée) d'une poche chauffée au four micro-ondes avant son application.
Très souvent cela suffit à diminuer l’inquiétude et la douleur.
Par la suite, si malgré tout votre enfant n’est pas soulagé, vous pouvez alors lui donner un antalgique (médicament antidouleur comme le paracétamol ou l’ibuprofène).
Quelques affections ou symptômes courants
En cas de rhume simple, il suffit souvent de moucher régulièrement votre enfant et qu’il se repose. Vous pouvez également lui laver le nez avec du sérum physiologique pour l’aider à mieux respirer.
*En cas de fièvre, même importante (supérieure à 39°C), si cela ne modifie pas le comportement de votre enfant (de plus de 3 mois), il n’est pas indispensable de lui donner tout de suite un médicament. En effet, la fièvre est une réaction naturelle du corps qui l’aide à lutter contre les microbes. La faire baisser c’est limiter ses défenses naturelles. Un médicament ne sera utile que pour diminuer son inconfort.
En revanche, il est recommandé de le faire boire å la demande une solution de réhydratation orale (SRO), 1 sachet dans 200 ml d'eau.
En cas de diarrhée, le principal risque est la déshydratation, surtout s'il s'agit d'un nourrisson. Il faut donc faire boire votre enfant, régulièrement et fréquemment par petites quantités. Les médicaments anti-diarrhéiques ne sont pas recommandés, notamment en cas de gastro-entérite, qui disparaît seule en quelques jours sans médicaments, en adaptant l'alimentation de votre enfant.
> Voir aussi la fiche sur la gastroentérite sur le site Mpedia
Si votre enfant a mal aux oreilles, à la gorge, au ventre ou à la tête, vous trouverez des conseils dans la brochure « Votre enfant a mal. Que faire ? » réalisée par SPARADRAP.
> Télécharger la brochure « Votre enfant a mal. Que faire ? »
> Voir aussi le dossier de conseils « Que faire si mon enfant a mal »
Attention :
ne lui donnez jamais un médicament qui a été prescrit pour quelqu'un d'autre.
=> Un même symptôme peut être provoqué par des maladies différentes et cela pourrait retarder sa prise en charge.
=> La présentation des médicaments diffère selon l'âge et le poids, il y a donc un risque de surdosage.
Quand vous ne savez pas quoi faire
Vous pouvez demander à votre pharmacien, il vous conseillera éventuellement un médicament disponible sans prescription ou il saura vous dire s'il vaut mieux que votre enfant voie un médecin.
Mais vous êtes la personne qui connaît le mieux votre enfant. Si vous pensez que quelque chose ne va pas, n’hésitez à prendre rendez-vous chez votre médecin. Il vaut mieux consulter « pour peu de chose » que passer à côté d’un problème important.
Que vous soyez plutôt d’un caractère « inquiet » ou « cool », les cas où la consultation d’un médecin est nécessaire sont listés ci-dessous.
Consultez rapidement un médecin dans les cas suivants :
 votre bébé a moins de 3 mois et a de la fièvre (plus de 38,5°C). En effet, jusqu’à 3 mois, un bébé est censé être encore protégé par les anticorps de sa mère, une fièvre importante est parfois le signe d'une infection sérieuse et doit toujours conduire à consulter un médecin ;
votre bébé a moins de 3 mois et a de la fièvre (plus de 38,5°C). En effet, jusqu’à 3 mois, un bébé est censé être encore protégé par les anticorps de sa mère, une fièvre importante est parfois le signe d'une infection sérieuse et doit toujours conduire à consulter un médecin ;- votre enfant a plus de 3 mois et une fièvre inexpliquée qui dure depuis plus de 3 jours (supérieure à 38,5°C) ;
- votre enfant vomit et a la diarrhée. Il risque de se déshydrater ;
- vous avez repéré chez votre enfant un changement de comportement inhabituel ou inquiétant : il dort mal, mange mal, ne joue plus, évite d’utiliser l’un de ses membres, est somnolent, a changé de regard… ;
- votre enfant se plaint de douleurs dans les jambes (sans cause apparente ou connue) ;
- votre enfant présente une éruption cutanée ou un œdème (gonflement) ;
- votre enfant a froid aux mains et aux pieds (sans raison particulière) ;
- votre enfant présente une pâleur soudaine inhabituelle ;
- votre enfant a fait une chute sur la tête.
Si votre enfant est fiévreux ou s’il a mal, vous pouvez lui donner un médicament (un antipyrétique ou un antidouleur, comme le paracétamol) pour le soulager avant d’aller chez le médecin. Cela ne l’empêchera pas de faire son diagnostic.
Après une consultation médicale
Si le médecin a prescrit des médicaments à votre enfant, il est important de respecter les doses, le rythme des prises et la durée du traitement, même si votre enfant va mieux. Sachez que le médecin évalue toujours le bénéfice et le risque avant de donner un médicament à votre enfant.
> Voir le chapitre « Comment bien donner un médicament à mon enfant ? »
Il arrive aussi que votre médecin vous donne juste des conseils pour aider votre enfant jusqu’à sa guérison (repos, diète, nettoyage de nez…). Ne vous inquiétez pas, un médicament n’est pas toujours la solution : dans certains cas il faut juste laisser au corps le temps de se défendre par ses propres moyens et avec votre soutien.
Un médicament n'est pas la réponse à toutes les situations
Vous pouvez souhaiter que le médecin prescrive des médicaments pour guérir votre enfant ou traiter ses symptômes au plus vite, afin que chacun puisse reprendre ses activités normales. Dans la réalité, ce n’est pas toujours nécessaire, voire pas recommandé.
Certains symptômes sont utiles.
Par exemple, la fièvre est une réaction naturelle du corps qui aide à lutter contre les microbes. Il n’est donc pas recommandé de donner systématiquement un médicament pour la faire baisser, sauf si la fièvre le gêne et modifie son comportement (attention : chez le nourrisson de moins de 3 mois, il faut consulter rapidement un médecin).
Ce n’est pas toujours efficace de donner un médicament, et parfois, cela fait plus de mal que de bien.
Par exemple, en cas d’infection par un virus (grippe), prendre des antibiotiques ne permet pas de guérir plus vite ni d’éviter des complications. En revanche, cela peut provoquer une diarrhée ou une allergie, entraîner le développement de bactéries résistantes aux antibiotiques et diminuer leur efficacité...
L’utilisation de certains médicaments est déconseillée voire dangereuse.
Par exemple, les médicaments « anti-rhume » décongestionnants (contenant de la pseudoéphédrine), qui sont vendus en pharmacie sans ordonnance, ne doivent pas être utilisés chez les enfants de moins de 15 ans car ils peuvent provoquer des effets indésirables graves. De même pour certains sirops ou comprimés contre la toux.
Il importe aussi d'être vigilant concernant la prise de deux médicaments différents (l'un prescrit par votre médecin et l'autre acheté librement), dont les principes actifs conjugués peuvent avoir des effets néfastes.
Lutter contre la maladie fatigue votre enfant, même s’il prend des médicaments.
Prévoir un temps de convalescence, pendant lequel il va se reposer, peut lui permettre de retrouver toute son énergie avant de reprendre ses activités normales.
* : recommandations officielles de la Société Française de Pédiatrie
Comment bien donner un médicament ?
Voici quelques informations importantes à connaître et à respecter pour éviter des erreurs et s'assurer de l'efficacité du traitement.
Ne pas mélanger les pipettes / cuillères doseuses
 Chaque médicament contient en général dans son emballage tous les éléments nécessaires à son administration (pipette, seringue orale, gobelet ou cuillère doseuse…). D’un médicament à un autre (de même marque ou pas), les graduations et dosages sont différents.
Chaque médicament contient en général dans son emballage tous les éléments nécessaires à son administration (pipette, seringue orale, gobelet ou cuillère doseuse…). D’un médicament à un autre (de même marque ou pas), les graduations et dosages sont différents.
Il faut donc être vigilant et utiliser uniquement le dispositif d’administration fourni avec le médicament, pour éviter un surdosage ou un sous-dosage.
Cela est aussi valable pour certains médicaments d’une même marque, qui selon les tranches d’âge, disposent de pipettes ou de cuillères semblables alors que leurs dosages sont différents.
Veillez bien à toujours ranger la pipette ou la cuillère correspondante dans la boîte du médicament après l’avoir rincée.
> Pour en savoir plus : voir le site de l’Agence Nationale de Sécurité du Médicament
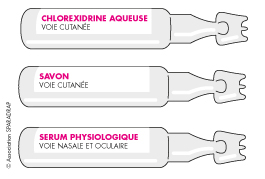 Éviter la confusion entre les produits en dosettes à usage unique
Éviter la confusion entre les produits en dosettes à usage unique
De nombreux produits sont présentés sous la forme de dosettes (unidoses), tels que :
- des médicaments (collyres ophtalmiques) ;
- des dispositifs médicaux (sérum physiologique, produits d’entretien des lentilles, eau oxygénée) ;
- des cosmétiques...
Pour éviter toute erreur, il faut garder chaque produit dans sa boîte d’origine, pour bien l’identifier.
En effet, ces dosettes se ressemblent beaucoup et le nom du produit est écrit en tout petit, il y a donc un risque important de les confondre, ce qui peut entraîner des accidents graves (par exemple en mettant des gouttes de désinfectant dans l’œil de votre enfant à la place de sérum physiologique).
> Pour en savoir plus : voir le site de l’Agence Nationale de Sécurité du Médicament
Éviter les interactions entre plusieurs médicaments
Certains médicaments ne doivent pas être pris ensemble, en même temps ou pendant une même période, parce que :
- soit leurs principes actifs sont identiques et il y a risque de surdosage ;
- soit leurs actions ne sont pas compatibles (l’un empêche l’autre d’être actif) ;
- soit leurs effets indésirables se cumulent.
Il est donc important d’informer le médecin et le pharmacien si votre enfant prend déjà un ou plusieurs médicaments, afin qu’il prescrive ou vous délivre un produit adapté à la situation. Généralement, s’il y a un risque, ils vous posent la question.
A la maison, en cas de doute, vous pouvez consulter la notice d’utilisation qui précise les associations médicamenteuses à éviter (dans la rubrique 2), ou bien demander conseil à votre pharmacien.
Respecter la forme et le mode d’administration
Pour certains médicaments, modifier la forme et le mode d’administration indiqués par le médecin ou sur la notice peut diminuer voire empêcher leur action :
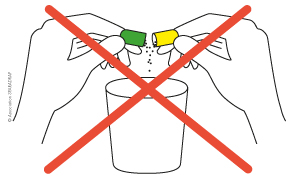 il ne faut pas ouvrir une gélule et diluer son contenu dans de l’eau à boire car la gélule protège le principe actif de l’acidité de l’estomac : le médicament sera détruit et inefficace ;
il ne faut pas ouvrir une gélule et diluer son contenu dans de l’eau à boire car la gélule protège le principe actif de l’acidité de l’estomac : le médicament sera détruit et inefficace ;
 il ne faut pas diluer un médicament dans une grande quantité de liquide (un biberon par exemple), parce que si votre enfant ne boit pas tout, il n’absorbera pas la dose efficace de médicament ;
il ne faut pas diluer un médicament dans une grande quantité de liquide (un biberon par exemple), parce que si votre enfant ne boit pas tout, il n’absorbera pas la dose efficace de médicament ;
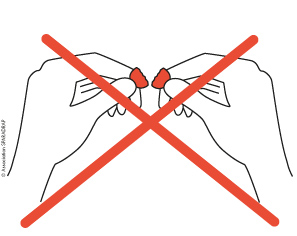 il ne faut pas couper en deux un comprimé si le mot « sécable » n’est pas inscrit sur la boîte, même si le comprimé comporte une rainure : le fabricant ne garantit pas que le principe actif soit correctement réparti entre les deux moitiés.
il ne faut pas couper en deux un comprimé si le mot « sécable » n’est pas inscrit sur la boîte, même si le comprimé comporte une rainure : le fabricant ne garantit pas que le principe actif soit correctement réparti entre les deux moitiés.
Demandez à votre médecin ou votre pharmacien ce qu’il est possible de faire pour faciliter la prise du médicament par votre enfant. Il existe peut-être sous une autre forme (en sirop, en poudre à diluer, en suppositoire…), ou bien le pharmacien peut adapter sa préparation.
Respecter les doses et la fréquence des prises
La quantité de médicament à donner à votre enfant est toujours indiquée en fonction de son âge et de son poids, que ce soit sur la notice ou sur l’ordonnance du médecin (le poids de votre enfant doit y être noté, c’est obligatoire).
La fréquence des prises est également importante car elle tient compte de la durée d’action du médicament. Elle permet d’avoir toujours une quantité suffisante de principe actif dans le corps pour être efficace.
Pour vous assurer de respecter les doses et d'éviter les oublis, n’hésitez pas à noter la quantité donnée et à quelle heure, surtout la nuit.
Attention :
=> en cas d'oubli, il ne faut pas doubler la dose la fois d'après pour compenser ;
=> si les symptômes ne disparaissent pas après l'administration du médicament (par exemple, votre enfant a toujours plus de 39°C de fièvre), ne lui redonnez pas une nouvelle dose de médicament immédiatement. Demandez conseil à votre pharmacien, ou à votre médecin.
En cas d’automédication
La quantité et la fréquence des prises sont précisées dans la notice d’utilisation du médicament, dans la posologie (rubrique 3). Souvent, le pharmacien écrit ces informations sur la boîte, pour vous aider.
Si le médicament est prescrit par votre médecin
Respectez ce qui est indiqué sur l’ordonnance, même si, parfois, cela contredit la notice (par exemple, une dose plus forte ou un médicament donné à un enfant plus jeune).
Dans ce cas, votre médecin doit vous prévenir et, en cas de doute, n’hésitez pas à le lui redemander. De même, si le pharmacien s’interroge au moment de vous délivrer le médicament, il peut contacter votre médecin pour confirmation.
Faut-il réveiller mon enfant la nuit ?
Ce n’est pas toujours nécessaire. Par exemple, quand la posologie indique « 3 fois par jour », cela signifie 3 fois dans la journée, sans inclure la nuit. Si besoin, votre médecin le précisera sur l’ordonnance. En cas d’automédication, suivez les indications de la notice (rubrique 3), qui précise le nombre de prises et le délai à respecter entre les prises.
Attention :
dans le cas d’un traitement antibiotique pour une infection grave, il est important de ne pas sauter de prise. En cas d'oubli, consultez la notice pour savoir quoi faire (rubrique 3, paragraphe "Durée du traitement").
Prendre un médicament à l’école
Si votre enfant va à l’école, précisez-le à votre médecin pour qu’il adapte le traitement (par exemple avec un médicament à libération prolongée), car il n’est pas possible de prendre un médicament pendant le temps scolaire (sauf en cas de maladie chronique, auquel cas un Projet d’Accueil Individualisé - PAI - peut être mis en place avec l’école).
Ne pas arrêter le traitement sans avis médical
Même si votre enfant va mieux ou semble guéri, l’arrêt de certains traitements avant la fin peut entraîner un risque de rechute.
Par exemple, en cas de traitement par des antibiotiques ou des vermifuges (contre les vers) : la disparition des symptômes n'est pas un signe que toutes les bactéries ou tous les vers ont bien été éliminés. Il peut en rester quelques-un qui se développeront de nouveau en cas d'arrêt prématuré du traitement.
Certains traitements ne doivent pas être arrêtés brutalement car cela peut provoquer un syndrome de sevrage, voire entraîner une hospitalisation.
Par exemple, en cas de traitement par cortisone sur une longue période.
En l'absence de signes indésirables, si vous souhaitez arrêter de donner un médicament à votre enfant, demandez l’avis de votre médecin.
Dans certains cas rares mais graves, des signes d’alerte doivent vous conduire à suspendre le traitement et à contacter immédiatement un médecin (appeler le 15). Par exemple : en cas d'éruption cutanée, de gonflement, de difficultés à respirer, de sensation de brûlure intense... (se référer à la notice du médicament, rubrique 4)
En cas d’opération chirurgicale programmée
Si votre enfant doit se faire opérer, il ne doit pas prendre certains médicaments, notamment ceux qui fluidifient le sang pendant au moins 10 jours avant l’intervention. Cela vous est précisé par l’anesthésiste et le chirurgien au moment des consultations préopératoires. Si votre enfant prend des médicaments, avec ou sans ordonnance, il est important de les signaler lors de ces consultations.
Si je n'arrive pas à donner son médicament à mon enfant ?
Votre enfant refuse de prendre son médicament, parce qu’il n’a pas bon goût, parce qu’il ne comprend pas pourquoi il doit le faire… Comment l’aider à le prendre malgré tout ?
Pour favoriser la prise du médicament
 L’influence du psychisme est importante dans le processus de guérison, voici donc quelques indications sur des attitudes plus ou moins adaptées :
L’influence du psychisme est importante dans le processus de guérison, voici donc quelques indications sur des attitudes plus ou moins adaptées :
En présence de votre enfant
- essayez de ne pas faire de remarques négatives sur son traitement. Par exemple, ne dites pas que son médicament ne sert à rien, ou que vous ne faites pas confiance au médecin ;
- dans la mesure du possible, ne montrez pas vos désaccords entre parents sur son traitement si vous en avez ;
- évitez de laisser certaines personnes (nounou, proches...) remettre en cause la prescription du médecin (ex : dose considérée comme trop forte…).
Quand vous lui parlez
- ne lui mentez pas : ne lui cachez pas que vous lui donnez un médicament, ne lui dites pas que ça a bon goût si ce n’est pas le cas ;
- si votre enfant est jeune, ne le prévenez pas trop tôt, car il ne maîtrise pas la notion du temps et risque de trop anticiper ;
- ne comparez pas le médicament à un bonbon : votre enfant ne doit pas penser qu’il peut en manger sans raison médicale ;
- ne présentez pas un médicament comme une punition : cela peut compliquer un traitement au long cours ;
- en dernier lieu, faites-lui comprendre qu’il n’a pas le choix, pour qu’il sache que la prise du médicament n’est pas négociable.
> Voir les « Conseils de communication adaptés à l’âge de l’enfant » extraits du livre
« Votre enfant et les médicaments » des Éditions de l'Hôpital Sainte-Justine
Si le médicament n’a pas bon goût
 Voici quelques « trucs* » que vous pouvez essayer pour faire passer le mauvais goût d’un médicament :
Voici quelques « trucs* » que vous pouvez essayer pour faire passer le mauvais goût d’un médicament :
Avant de prendre le médicament
- mettez le médicament au réfrigérateur : le froid diminue la perception du goût ;
- proposez lui de manger un aliment pâteux qui « colle sur la langue », comme une banane ou du fromage : cela diminue la perception du goût du médicament ;
- « cachez » le goût du médicament avec de la menthe ou de la réglisse : en se brossant les dents, en mangeant un bonbon…
Pendant la prise du médicament
- si le médicament est liquide, faites le boire à votre enfant avec une paille ou à la pipette, cela sollicite moins de papilles gustatives ;
- proposez-lui de le prendre en alternant avec quelque chose qu’il aime : une compote, une crème dessert, de l’eau avec du sirop…
Juste après la prise du médicament
- proposez à votre enfant de manger quelque chose qu’il aime beaucoup ;
- si le médicament doit se prendre à jeun : votre enfant peut se rincer la bouche et/ou boire de l’eau.
Pour un bébé
- s’il n’y a pas de contre-indication, donnez le médicament juste avant le repas, quand votre bébé a très faim ;
- vous pouvez lui donner son médicament dans une pipette placée sur le côté de la langue, près de la joue ;
- après avoir inséré le médicament dans sa bouche, soufflez délicatement sur son visage pour qu’il l’avale, car cela déclenche le réflexe de déglutition.
Si votre enfant n’aime pas la texture, la taille du médicament…
- votre enfant a entre 2 et 5 ans : proposez-lui de « donner le médicament » à son doudou, une peluche ou une poupée avant de le prendre ;
- votre enfant trouve son comprimé trop gros : comparez le comprimé à un aliment plus volumineux qu’il a déjà avalé ou proposez-lui de s’entrainer à avaler tout rond un aliment de même taille (boulette de pain…), ou encore de boire avant la prise du comprimé. Faites confiance à votre enfant, il a des ressources que vous n’imaginez pas toujours.
Pour un collyre, des gouttes auriculaires
- administrez les gouttes oculaires ou auriculaires à température ambiante ou réchauffez le flacon au creux de votre main, pour éviter un contact froid désagréable ;
- appliquez un collyre au coin de l'œil, paupière fermée, puis faites ouvrir les yeux de votre enfant pour que le liquide se déploie.
Si votre enfant recrache le médicament ou vomit…*
- si votre enfant recrache aussitôt le médicament, vous pouvez lui redonner une dose complète car la quantité de médicament restant dans sa bouche est minime ;
- si votre enfant vomit dans les 10 minutes qui suivent la prise du médicament : vous pouvez lui redonner la dose complète
(Attention : si votre petit enfant est sujet aux régurgitations, en cas de doute, demandez l'avis de votre médecin) ; - si plus de 10 minutes se sont écoulées quand il vomit : demandez l’avis de votre médecin ou de votre pharmacien car chaque médicament n’est pas absorbé à la même vitesse ;
- si malgré tout cela ne passe pas, voyez avec votre médecin s’il est possible de prendre le médicament sous une autre forme (suppositoire, spray…).
Et si, malgré tout, votre enfant refuse
 Votre enfant a moins de 6 ans
Votre enfant a moins de 6 ans
- ne dramatisez pas, laissez-lui un peu de temps pour s’apaiser, puis retentez de lui donner son médicament un peu plus tard ;
- proposez-lui une récompense s’il prend son médicament (par exemple, son dessin animé préféré).
Votre enfant a plus de 6 ans
- vous pouvez voir avec lui quelle solution pourrait l’aider ;
- proposez-lui de participer, d’apprendre à faire lui-même.
Changer la présentation du médicament ?
Vous pouvez demander à votre médecin s’il peut prescrire le médicament sous une autre forme (par exemple, un médicament à libération prolongée qui a une durée d’action plus longue, pour limiter les prises).
Mais parfois, pour certaines maladies, il n’est pas possible de modifier le mode d’administration (par exemple en cas de diabète : l’insuline ne peut pas être avalée car le système digestif la détruit, elle ne peut être administrée que par des piqûres).
Expliquez alors à votre enfant pourquoi ce n’est pas possible de prendre son médicament autrement.
* Certains "trucs" ou conseils donnés dans cette page sont issus du livre Votre enfant et les médicaments, des Éditions du CHU Sainte-Justine > Voir la bibliographie en bas d'article
Si mon enfant a pris des médicaments par accident
Les intoxications par ingestion de produits dangereux et de médicaments figurent parmi les premières causes de mortalité chez les enfants en bas âge…
Que faire en premier si votre enfant avale un ou plusieurs médicament(s) ?
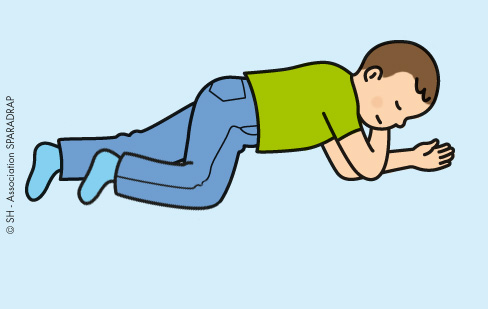 si votre enfant est inconscient :
si votre enfant est inconscient :
placez-le en position latérale de sécurité,
sur le côté gauche ;
> Voir les étapes en image
> Voir le geste en vidéo
- s’il est conscient : restez près de lui, surveillez-le, rassurez-le ;
- ne le faites pas vomir (sans avis médical) ;
- ne le faites ni boire, ni manger ;
- identifiez le ou les médicament(s) qu'il a avalé(s) ;
- contactez le 15 : ce service vous met en relation avec un médecin qui peut vous aider à effectuer les premiers gestes et il coordonne les équipes de secours pour faire intervenir les plus proches (ailleurs en Europe, appelez le 112) ;
- rassemblez dans un sac tous les médicaments que votre enfant est susceptible d’avoir avalés, pour les donner au médecin qui va le prendre en charge.
Auteurs
Ce dossier a été rédigé par un groupe de travail.
Pour l'association SPARADRAP :
Caroline BALLÉE, Sandrine HERRENSCHMIDT, Françoise GALLAND, Dr Catherine DEVOLDÈRE.
Autre membres :
Pr Jean-Louis CHABERNAUD, Florence DANIEAU, Hélène GAILLARD, Véronique KROELL, Éric PELUS, Mathilde REMY, Perrine VENNETIER.
Merci à tous les professionnels et familles qui ont bien voulu faire un relecture de ce dossier.
> Voir la liste complète des participants
Illustrations : Sandrine HERRENSCHMIDT
Crédits photos : Agence BSIP
Citation du chapitre "Conseils de communication adaptés à l’âge de l’enfant" extrait du livre "Votre enfant et les médicaments", reproduit avec l'aimable autorisation des Éditions du CHU Sainte-Justine
Dossier créé en mars 2016. Mise à jour : mars 2020


